Esercizi sulla struttura dell’atomo
In questo articolo potrete trovare 13 esercizi sulla struttura dell’atomo, progettati per l’esame di Chimica Generale e Inorganica a livello universitario. Il materiale è adatto a studenti di chimica, biologia, ingegneria, fisica e a chiunque desideri approfondire o ripassare le basi dell’argomento.
Gli esercizi sulla struttura dell’atomo coprono aspetti fondamentali della chimica inorganica e fisica, tra cui:
- proprietà quantistiche: energia e massa dei fotoni (equazione di Planck, relazione di De Broglie);
- isotopia e peso atomico: calcolo delle masse isotopiche e abbondanze percentuali;
- configurazione elettronica: distribuzione degli elettroni secondo i principi di Aufbau, Pauli e Hund;
- numeri quantici: descrizione e implicazioni per gli elettroni di valenza;
- proprietà atomiche e ioniche: potenziale di ionizzazione, raggio atomico, carica nucleare effettiva;
- transizioni elettroniche: schermatura e stabilità negli stati elettronici di metalli e non metalli.
L’articolo si distingue per chiarezza e rigore: ogni esercizio è svolto senza tralasciare alcun passaggio, permettendo allo studente di comprendere l’argomento in modo completo e approfondito.
Scarica gli esercizi sulla struttura dell’atomo
Ottieni il documento contenente 13 esercizi sulla struttura dell’atomo pensati per l’esame di chimica generale ed inorganica.
Esercizi sulla struttura dell’atomo: autori e revisori
Leggi...
Esercizi sulla struttura dell’atomo: testi degli esercizi
Svolgimento.
![]()
Sostituendo la frequenza nell’equazione di Planck si ottiene:
![]()
Il valore trovato è quello di un singolo fotone. Per una mole di fotoni, si ha:
![]()
Svolgimento.
![]()
Esprimendo ![]() in m e
in m e ![]() in
in ![]() , si ottiene:
, si ottiene:
![]()
Per una mole di fotoni:
![]()
![]()
- La relazione di De Broglie
![Rendered by QuickLaTeX.com \[ \lambda = \frac{h}{mv} \]](data:image/svg+xml;base64,PHN2ZyB4bWxucz0iaHR0cDovL3d3dy53My5vcmcvMjAwMC9zdmciIHdpZHRoPSI2MCIgaGVpZ2h0PSIzNiIgdmlld0JveD0iMCAwIDYwIDM2Ij48cmVjdCB3aWR0aD0iMTAwJSIgaGVpZ2h0PSIxMDAlIiBzdHlsZT0iZmlsbDojY2ZkNGRiO2ZpbGwtb3BhY2l0eTogMC4xOyIvPjwvc3ZnPg==)
associa una lunghezza d’onda ben definita a una qualunque particella caratterizzata da una determinata quantità di moto. Particelle microscopiche hanno quindi lunghezze d’onda non trascurabili, mentre corpi del mondo macroscopico hanno lunghezze d’onda piccolissime, per cui il comportamento ondulatorio non riveste particolare importanza ed il moto di tali corpi è descrivibile dalle leggi della meccanica classica. La relazione di De Broglie rivestirà un ruolo fondamentale nella determinazione del principio di indeterminazione di Heisenberg. ↩
 .
.
Svolgimento.
![Rendered by QuickLaTeX.com \[\boxcolorato{chimica}{ \text{peso atomico medio} = \frac{(\text{23,993} \cdot \text{78,60}) + (\text{24,994} \cdot \text{10,11}) + (\text{25,991} \cdot \text{11,29})}{100} = \text{24,32} \, \text{u} }\]](https://quisirisolve.com/wp-content/ql-cache/quicklatex.com-0727320885a175328f36ed5ea79dcb69_l3.png)
Svolgimento.
![]()
![]()
Possiamo scrivere la seconda equazione in funzione di una singola abbondanza e calcolare di conseguenza:
![]()
![]()
da cui:
![]()
Allora:
![]()
Svolgimento punto 1.
Il pedice indica il numero di protoni e quindi anche di elettroni. Il calcolo del numero di neutroni è ottenibile facendo una semplice differenza tra il numero di massa ed il numero atomico:
![]()
Svolgimento punto 2.
Anche in questo caso basta ricordare le definizioni di numero atomico e numero di massa per calcolare il numero di protoni, elettroni e neutroni:
![]()
![]()
Svolgimento.
Gli elettroni di ogni specie vengono distribuiti nei livelli energetici secondo un meccanismo che tiene conto del principio della costruzione progressiva (o regola di Aufbau), del principio di esclusione di Pauli e delle regole di Hund.
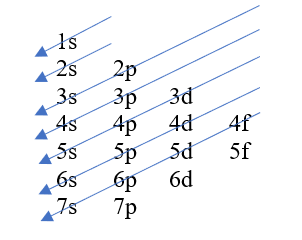
Figura 1
![]()
![]()
![]()
![]()
![]()
- La configurazione elettronica parziale di un atomo o di uno ione tiene conto della configurazione elettronica del livello più esterno e indica quella dei livelli precedenti con il simbolo relativo al gas nobile precedente l’elemento dell’atomo o dello ione in esame. ↩
Svolgimento.
Il numero quantico ![]() , o numero quantico principale, può assumere tutti i valori interi da 1 a infinito:
, o numero quantico principale, può assumere tutti i valori interi da 1 a infinito: ![]()
Il numero quantico ![]() , o numero quantico secondario, dipende dal numero quantico principale e può assumere tutti i valori compresi tra 0 ed
, o numero quantico secondario, dipende dal numero quantico principale e può assumere tutti i valori compresi tra 0 ed ![]() :
: ![]() .
.
Il numero quantico ![]() , o numero quantico magnetico, dipende dal numero quantico secondario
, o numero quantico magnetico, dipende dal numero quantico secondario ![]() e può assumere tutti i valori interi compresi tra
e può assumere tutti i valori interi compresi tra ![]() e
e ![]() :
: ![]() .
.
Per convenzione, gli orbitali con ![]() sono indicati con la lettera
sono indicati con la lettera ![]() , quelli con
, quelli con ![]() con la lettera
con la lettera ![]() , quelli con
, quelli con ![]() con la lettera
con la lettera ![]() , quelli con
, quelli con ![]() con la lettera
con la lettera ![]() .
.
In base a ciò, è possibile definire i valori dei quattro elettroni del guscio esterno dell’atomo di carbonio:
 ,
,  ,
,  , spin =
, spin = 
 ,
,  ,
,  , spin =
, spin = 
 ,
,  ,
,  , spin =
, spin = 
 ,
,  ,
,  , spin =
, spin =  .
.
Si può notare che ![]() , quindi l’elemento apparterrà al secondo periodo della tavola periodica, e che i primi due elettroni apparterranno all’orbitale di tipo
, quindi l’elemento apparterrà al secondo periodo della tavola periodica, e che i primi due elettroni apparterranno all’orbitale di tipo ![]() del secondo livello ma con spin opposto. Gli altri due elettroni avranno invece spin parallelo e occuperanno due posizioni diverse degli orbitali di tipo
del secondo livello ma con spin opposto. Gli altri due elettroni avranno invece spin parallelo e occuperanno due posizioni diverse degli orbitali di tipo ![]() , come mostrato dai valori di
, come mostrato dai valori di ![]() .
.
![]()
- La carica nucleare effettiva,
 , può essere definita come la carica apparente che agisce su un particolare elettrone.
, può essere definita come la carica apparente che agisce su un particolare elettrone.  è minore della carica nucleare
è minore della carica nucleare  , dal momento che ogni elettrone esterno è sottoposto all’attrazione del nucleo parzialmente schermato dagli elettroni interni. I valori della carica nucleare effettiva sono massimi per gli elettroni più vicini al nucleo (quindi poco schermati), minimi per i più lontani (elettroni di valenza).
, dal momento che ogni elettrone esterno è sottoposto all’attrazione del nucleo parzialmente schermato dagli elettroni interni. I valori della carica nucleare effettiva sono massimi per gli elettroni più vicini al nucleo (quindi poco schermati), minimi per i più lontani (elettroni di valenza).
↩
Svolgimento.
- un contributo 0 per gli elettroni che si trovano nei livelli ad energia superiore rispetto a quello dell’elettrone considerato;
- un contributo di
 per gli elettroni presenti nello stesso livello energetico;
per gli elettroni presenti nello stesso livello energetico; - un contributo di
 per ciascun elettrone di tipo
per ciascun elettrone di tipo  o
o  che si trovi nel livello immediatamente sottostante;
che si trovi nel livello immediatamente sottostante; - un contributo di 1 per ciascuno degli elettroni degli orbitali
 o
o  sottostanti e per i rimanenti elettroni interni.
sottostanti e per i rimanenti elettroni interni.
La configurazione elettronica dello zinco è:
![]()
da cui
![]()
dove:
 è il numero di elettroni dell’atomo di zinco;
è il numero di elettroni dell’atomo di zinco; è il contributo attribuito all’altro elettrone del livello esterno
è il contributo attribuito all’altro elettrone del livello esterno  ;
; è il contributo attribuito agli 8 elettroni dei livelli
è il contributo attribuito agli 8 elettroni dei livelli  e
e  ;
; è il contributo dei restanti 20 elettroni degli strati più interni.
è il contributo dei restanti 20 elettroni degli strati più interni.
Svolgimento.
Svolgimento.
Svolgimento.
Svolgimento.
Svolgimento.
Bibliografia
Leggi...
Esercizi tratti da: M. Schiavello, L. Palmisano – Fondamenti di Chimica – II Edizione – 2006 EdiSeS S.r.l. – Napoli – Stampato presso la tipolitografia Sograte srl.
Tutti gli articoli di chimica inorganica
Leggi...
- Esercizi sulla struttura dell’atomo
- Esercizi sui legami chimici
- Esercizi sulla stechiometria delle reazioni chimiche
- Esercizi sul calcolo stechiometrico
- Esercizi su stechiometria dei composti
- Esercizi sulle leggi dei gas
- Nomenclatura chimica
- Esercizi sulle proprietà colligative
- Esercizi sulla concentrazione
- Esercizi sul bilanciamento delle reazioni chimiche acido-base
- Reazioni redox
- Esercizi sulla termochimica
- Esercizi di cinetica chimica
- Esercizi sull’equilibrio nelle soluzioni acquose
- Esercizi sull’equilibrio chimico
- Esercizi sulla cella elettrolitica
- Esercizi sulla cella elettrochimica
Tutte le cartelle di chimica inorganica
Leggi...
Approfondimenti esterni
Leggi...
