Esercizi sui legami chimici
Questo articolo presenta un insieme di 13 esercizi sui legami chimici, concepiti per studenti di chimica, biologia, ingegneria e fisica, nonché per coloro che intendono approfondire le proprie conoscenze in preparazione agli esami di chimica generale e inorganica.
Curato da Nicolò Gullo e revisionato da Joan Pasqual Guilabert, il materiale proposto si distingue per il rigore scientifico e la chiarezza espositiva, affrontando tematiche fondamentali quali:
- Meccanica quantistica: analisi dell’energia e della massa dei fotoni attraverso le equazioni di Planck e De Broglie.
- Isotopia e peso atomico: determinazione della distribuzione isotopica e del peso atomico medio.
- Configurazione elettronica: assegnazione degli elettroni negli orbitali atomici in base ai principi di Aufbau, Pauli e Hund.
- Numeri quantici: identificazione e descrizione delle caratteristiche quantiche degli elettroni di valenza.
- Proprietà atomiche e ioniche: valutazione del potenziale di ionizzazione, della carica nucleare effettiva e del raggio atomico.
Questi esercizi sui legami chimici offrono un’opportunità di applicazione concreta delle leggi fondamentali della chimica e della fisica, fornendo un supporto essenziale per l’analisi del comportamento atomico e subatomico.
Per un approfondimento teorico, si invita alla consultazione dell’articolo completo sui legami chimici.
Esercizi sui legami chimici: autori e revisori
Leggi...
Esercizi sui legami chimici: testi degli esercizi
Svolgimento.
Facciamo riferimento alla formula:
dove
è la costante di Madelung, dipendente dal tipo di struttura cristallina e dal numero di coordinazione dei singoli ioni;
è il numero di Avogadro;
è la carica dello ione;
è la costante dielettrica nel vuoto;
è la distanza tra gli ioni.
Poiché il e il
hanno la stessa struttura cristallina, il valore della costante di Madelung sarà lo stesso,
, per cui:
- cloruro di calcio
- solfuro di sodio
- ossido di alluminio.
Svolgimento.
Per ricavare le formule di queste sostanze bisogna tenere conto del fatto che ogni composto deve essere elettricamente neutro. Dalla posizione degli elementi nella tavola periodica è possibile dedurre quale configurazione elettronica di gas nobile sarà raggiunta e quindi si può vedere la carica dello ione corrispondente.
-
Il cloro appartiene al gruppo VII B per cui tenderà ad assumere la configurazione elettronica dell’argon diventando
. Il calcio invece, appartenendo al gruppo II A, tenderà a perdere due elettroni dando il catione
. Per bilanciare la carica del
occorreranno due ioni
. La formula del composto sarà quindi
.
-
Lo zolfo appartiene al gruppo VI B per cui tenderà ad acquistare due elettroni dando lo ione
. Il sodio appartiene al gruppo I A e darà lo ione
. Per bilanciare la carica dello ione
occorreranno due ioni
. La formula del composto sarà
.
-
L’ossigeno appartiene al gruppo VI B e darà lo ione
, mentre l’alluminio, che appartiene al gruppo III B, darà luogo al catione
. Occorreranno due ioni
per bilanciare la carica dei tre ioni
per cui la formula sarà
.
Svolgimento.
Calcoliamo il numero totale di elettroni di valenza presenti nella molecola:
Determiniamo il numero di elettroni necessari perché ogni atomo raggiunga l’ottetto1 e l’atomo di idrogeno possieda due elettroni:
La differenza tra questi due valori () ci dà il numero di elettroni coinvolti nei legami. Dividendo per due, otteniamo il numero di coppie elettroniche condivise, cioè il numero di legami presenti nel composto, che risultano essere 4.
A questo punto uniamo tutti gli atomi tramite legami semplici

Figura 1.
Il numero di coppie condivise così facendo è 3. Per rispettare la regola dell’ottetto, uniamo con un doppio legame l’azoto e l’atomo di ossigeno bi-covalente non legato all’idrogeno
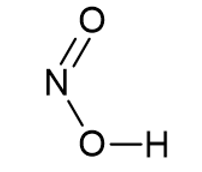
Figura 2.
Per completare la struttura, sistemiamo le restanti coppie attorno agli atomi, tenendo conto di dover rispettare la regola dell’ottetto.
-
La regola dell’ottetto prevede che gli elettroni si dispongano secondo una configurazione di grande stabilità nei livelli di energia s2p6, raggiungendo quindi la stessa configurazione elettronica dei gas nobili.
Svolgimento.
Calcoliamo il numero totale di elettroni di valenza presenti, ricordando che dobbiamo aggiungere due elettroni in più per ottenere la carica negativa dello ione
Affinché ciascun atomo possa avere il suo ottetto occorreranno
dei quali:
Questi possono essere ripartiti in due legami singoli ed un legame doppio

Figura 3.
Avendo impiegato solo 8 dei 24 elettroni di valenza, assegniamo i rimanenti 16 elettroni come coppie solitarie agli atomi, in modo che ciascuno di essi rispetti la regola dell’ottetto

Figura 4.
Svolgimento.
Usando le regole di Lewis, possiamo scrivere le seguenti formule di struttura per il cianogeno
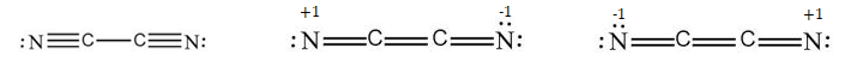
Figura 5.

Attribuendo le cariche formali2 ai vari atomi, possiamo facilmente dedurre che la struttura più probabile è la prima, nella quale tutti gli atomi hanno cariche formali uguali a zero.
-
La carica formale rappresenta la differenza tra il numero di elettroni di valenza dell’atomo neutro e il numero di elettroni assegnati all’atomo nella formula. Si calcola usando la formula
Un atomo può quindi assumere una carica formale positiva o negativa a seconda che il numero di elettroni che possiede risulti rispettivamente minore o maggiore di quello posseduto dall’atomo isolato. In una molecola neutra la somma delle varie cariche formali deve essere uguale a zero, mentre in uno ione deve coincidere con la carica dello ione. ↩
Svolgimento.
L’atomo di ossigeno agisce da donatore fornendo un doppietto elettronico all’atomo di boro in un legame dativo3.

Figura 6.
- Mentre il legame covalente è rappresentato normalmente tramite un trattino tra i simboli degli atomi legati, il legame di coordinazione è talvolta indicato con una freccia orientata dall’atomo donatore verso l’atomo accettore. Occorre però ricordare che una volta formato non è possibile distinguere un legame dativo da un normale legame covalente. ↩
Svolgimento.
L’atomo di zolfo possiede sei elettroni di valenza, di cui quattro sono impegnati nei legami con i 4 atomi di fluoro e due costituiscono una coppia solitaria.
Lo zolfo è quindi circondato da cinque coppie elettroniche e la molecola è del tipo
4 . Per rendere minime le repulsioni elettrostatiche, le cinque coppie si dispongono secondo una bipiramide trigonale, con la coppia solitaria che occuperà una posizione equatoriale.
Questa disposizione risulta quella preferita dal punto di vista energetico, poiché le interazioni tra 2 coppie poste a 120° risultano notevolmente minori di quelle tra due coppie a 90°. In questo modo il lone pair in posizione equatoriale interagirebbe praticamente soltanto con 2 coppie di legame a 90° piuttosto che con 3.
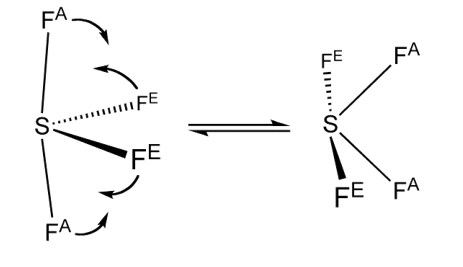
Figura 7.
- La disposizione spaziale dei vari legami può essere prevista in base alla teoria VSEPR (Valence Shell Electron Pair Repulsion) o teoria della repulsione tra le coppie di elettroni dello stato di valenza. In base a questa teoria le coppie elettroniche attorno ad un atomo centrale si dispongono sempre nello stesso modo, indipendentemente dal fatto che vi siano elettroni di legame o elettroni solitari. La struttura è dunque determinata dall’esigenza di rendere minime le repulsioni elettrostatiche tra le nuvole di carica delle coppie elettroniche condivise e non condivise. Ciò implica che le coppie di elettroni tendano a disporsi quanto più lontano possibile l’una dall’altra dando luogo a geometrie con caratteristiche che dipendono solo dal numero di coppie elettroniche presenti. ↩
Svolgimento.
L’atomo di iodio centrale possiede 7 elettroni di valenza, dei quali 5 sono impegnati nei legami con 5 atomi di fluoro. Lo iodio è quindi circondato da 6 coppie elettroniche, delle quali 5 sono coppie di legame e la sesta costituisce una coppia solitaria.
Per rendere minime le repulsioni, le 6 coppie si disporranno secondo una geometria ottaedrica, ma poiché la molecola è del tipo , la vera struttura geometria sarà una piramide a base quadrata.
- Nella teoria degli orbitali molecolari, si definisce ordine di legame la semidifferenza tra il numero di elettroni che occupano orbitali di legame e il numero di elettroni che occupano orbitali di antilegame. L’ordine di legame così può assumere valori interi, frazionari o nulli. Quanto più è alto, tanto maggiore è l’energia di legame e tanto minore sarà la distanza tra i due atomi. Se l’ordine di legame è nullo, la molecola non può esistere. ↩
Svolgimento.
Provvediamo a calcolare l’ordine di legame con la formula
La specie ha 15 elettroni (8 per ogni atomo, ma ha ceduto un elettrone). I 15 elettroni si dispongono negli orbitali molecolari come segue
dove gli orbitali di antilegame sono indicati con *.
Gli elettroni vengono distribuiti negli orbitali seguendo una sequenza che tiene conto della loro energia crescente. L’ordine è il seguente
.
Conteggiamo gli elettroni del guscio esterno (2s e 2p) e applichiamo la formula
Facciamo lo stesso per la specie : avrà 17 elettroni (8 per ogni atomo, ma ha acquisito un elettrone). I 17 elettroni si dispongono negli orbitali molecolari come segue
Come per il caso precedente, conteggiamo gli elettroni del guscio esterno (2s e 2p)
L’ordine di legame per la specie è
, mentre per la specie
è
. La specie
, quindi, presenta la minore distanza di legame.
Svolgimento.
Per mettere in ordine crescente di distanza di legame, abbiamo bisogno di calcolare l’ordine di legame di ogni specie. All’aumentare del valore, la distanza di legame diminuisce.
Quindi, in ordine crescente di distanza di legame
Svolgimento.
Per determinare la percentuale di carattere ionico del legame presente nei due composti, ci serviamo della relazione di Pauling
Per ottenere , utilizziamo i valori noti di elettronegatività
Sostituendo otteniamo
Nel la percentuale di carattere ionico è il 93,4%, mentre nel
è il
.
Esercizi sui legami chimici: bibliografia
Leggi...
Esercizi tratti da: M. Schiavello, L. Palmisano – Fondamenti di Chimica – II Edizione – 2006 EdiSeS S.r.l. – Napoli – Stampato presso la tipolitografia Sograte srl.
Tutti gli articoli di chimica inorganica
Leggi...
- Esercizi sulla struttura dell’atomo
- Esercizi sui legami chimici
- Esercizi sulla stechiometria delle reazioni chimiche
- Esercizi sul calcolo stechiometrico
- Esercizi su stechiometria dei composti
- Esercizi sulle leggi dei gas
- Nomenclatura chimica
- Esercizi sulle proprietà colligative
- Esercizi sulla concentrazione
- Esercizi sul bilanciamento delle reazioni chimiche acido-base
- Reazioni redox
- Esercizi sulla termochimica
- Esercizi di cinetica chimica
- Esercizi sull’equilibrio nelle soluzioni acquose
- Esercizi sull’equilibrio chimico
- Esercizi sulla cella elettrolitica
- Esercizi sulla cella elettrochimica
Tutte le cartelle di Chimica inorganica
Leggi...
